mTORC1信號通路整合細胞營養狀況、能量水平等信息動態調節細胞生長和代謝。蛋白質翻譯起始階段高度耗能,因此涉及到一係列複雜精細的調控,而mTORC1信號通路是其中的關鍵調節者。目前已知mTORC1複合體通過磷酸化修飾並調控(4E-BP)家族成員、S6K1等一係列下遊底物的活性,正向促進翻譯起始過程,但是該過程的具體細節尚未被完全闡明。
真核起始因子 4F (eIF4F) 介導的翻譯起始在腫瘤細胞惡性轉化過程中起關鍵作用,其活性增加可促進參與細胞增殖、存活以及腫瘤免疫逃逸的 mRNA翻譯起始。eIF4F複合物中,eIF4A1負責解開 mRNA 5'-UTR 區域的複雜二級結構,使得核糖體亞基得以結合並促進帽依賴性翻譯。目前開發的eIF4A 小分子抑製劑已在多項體外、體內研究中表現出良好的抗腫瘤活性。但是腫瘤細胞對eIF4A 小分子抑製劑產生耐藥的現象已被報道。
IBTK是一個Cullin 3家族的E3泛素連接酶複合體的底物識別亞基。IBTK在多種腫瘤中上調表達,並且在多種腫瘤細胞模型中表現出促增殖、抑凋亡的作用。雜合敲除IBTK可抑製Eμ-myc轉基因小鼠的淋巴瘤生成,提示其可能是一個重要的癌基因。但是目前對於IBTK發揮生物學功能的分子機製還知之甚少。
2024年5月10日,万博英超狼队网官方网 王陳繼團隊、上海市第一婦嬰保健院/同濟大學附屬婦產科醫院高昆團隊合作在eLife在線發表了題為 mTORC1/S6K1 signaling promotes sustained oncogenic translation through modulating CRL3IBTK-mediated ubiquitination of eIF4A1 in cancer cells的研究論文。該研究揭示了mTORC1/S6K1-IBTK-eIF4A1信號軸通過促進帽依賴性翻譯和癌蛋白表達的致癌分子途徑。

鑒於IBTK的生物學功能不清,研究人員開展了以下研究。首先通過蛋白複合體分離方法(AP-MS和BioID2)鑒定新的IBTK互作蛋白,進而確定CRL3IBTK的靶向底物。通過該方法發現並確證了eIF4A1是IBTK的互作蛋白。IBTK與eIF4A1相互作用並對eIF4A1進行多位點的單泛素化修飾(multiple mono-ubiquitination),此修飾不影響eIF4A1的蛋白穩定性,但是促進eIF4F複合物活性,進而達到調控下遊靶基因表達的效果。在多種宮頸癌細胞中敲除IBTK,導致MYC,CDK4,STAT1和CCND3等癌基因的蛋白表達水平下調,而對應 mRNA 水平基本不受 IBTK的影響,這提示IBTK 發揮轉錄後調控作用。一係列的細胞生物學實驗和小鼠荷瘤模型結果表明,IBTK正向調控癌細胞的增殖、遷移/侵襲、錨定非依賴性生長、體內瘤體生長和腫瘤免疫逃逸等惡性轉化表型,進一步明確了IBTK扮演癌基因角色。臨床樣本的免疫組化結果也支持IBTK過表達與宮頸癌的分級、不良預後正相關。此外,敲除IBTK使的腫瘤細胞對 eIF4A1 抑製劑誘導的細胞凋亡更加敏感,這提示了 IBTK 是克服 eIF4A 抑製劑耐藥的潛在幹預靶點。
後續的實驗證實IBTK是mTORC1的直接磷酸化修飾底物。此外,mTORC1下遊的 S6K1 激酶也可以磷酸化修飾 IBTK。在營養豐富的條件下,mTORC1和S6K1介導IBTK的雙重磷酸化修飾,激活CRL3IBTK複合體介導的 eIF4A1 非降解型泛素化修飾,促進帽依賴性翻譯起始。而在營養缺乏條件下,mTORC1/S6K1活性受到抑製,其對IBTK 的磷酸化修飾水平降低,低磷酸化水平的IBTK對 eIF4A1 的泛素化修飾顯著減弱,從而最終抑製相關mRNA的帽依賴性翻譯起始。癌細胞中存在mTORC1 過度激活或 IBTK 過表達的情況,CRL3IBTK複合體 對 eIF4A1泛素化修飾和帽依賴性翻譯起始作用增加,進一步促進腫瘤發生發展進程(圖一)。
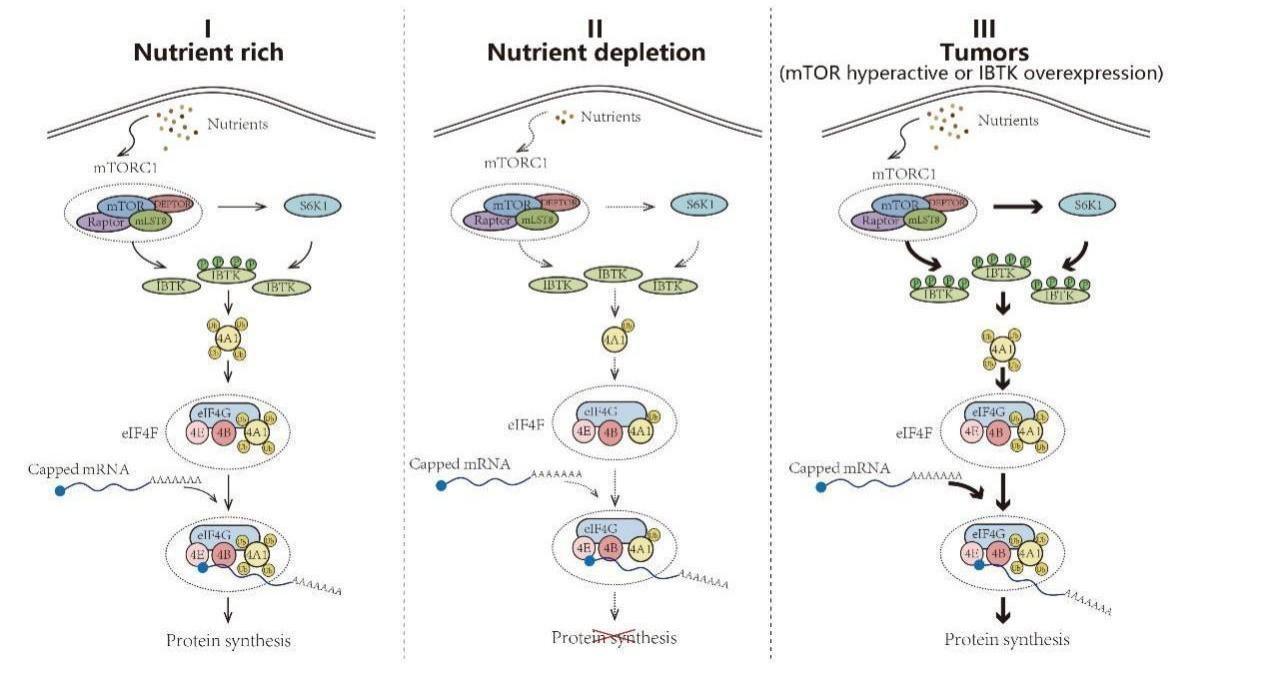
圖一、mTORC1/S6K1-IBTK-eIF4A1 信號通路調控的分子機製
這項工作首次提出了 “mTORC1/S6K1-IBTK-eIF4A1” 信號軸失調在腫瘤發生發展過程中的重要作用,加深了對癌細胞如何劫持翻譯機器以促進其生存的理解,並為開發新的癌症治療方法提供了潛在途徑。
万博英超狼队网官方网 博士生焦冬月,碩士生孫蕙茹(現人類表型組研究院博士生在讀)為該論文第一作者。王陳繼、高昆為該論文的通訊作者。
原文鏈接:https://elifesciences.org/reviewed-preprints/92236#metrics

